
Der Dritte Hauptsatz der Thermodynamik besagt, dass, wenn eine Substanz auf eine Temperatur nahe dem absoluten Nullpunkt (-273,15 °C oder 0 Kelvin) abkühlt, sich ihre Entropie, die ein Maß für die Unordnung oder Unsicherheit im System ist, einer konstanten und endlichen Größe annähert Wert.
Dieses Gesetz besagt, dass das Erreichen des absoluten Nullpunkts unendlich viele Schritte erfordern würde, was es in der Praxis unerreichbar macht. Darüber hinaus legt es nahe, dass alle Systeme bei dieser extremen Temperatur einen Zustand maximaler Ordnung und minimaler theoretischer Unordnung erreichen würden, was grundlegende Auswirkungen auf Bereiche wie die Quantenphysik und die Untersuchung neuer Materialien mit außergewöhnlichen Eigenschaften bei extrem niedrigen Temperaturen hat.
Nachfolgend finden Sie einige Beispiele, die dieses Prinzip veranschaulichen:
Beispiel 1: Eiskristalle
 Wenn Wasser auf sehr niedrige Temperaturen nahe dem absoluten Nullpunkt (0 K oder -273,15 °C) abgekühlt wird, verlieren die Wassermoleküle kinetische Energie und organisieren sich in einer hochgeordneten kristallinen Struktur, wodurch Eis entsteht. Unter diesen Bedingungen ist die thermische Energie so gering, dass die Moleküle kaum noch vibrieren und eine feste und regelmäßige Anordnung einnehmen.
Wenn Wasser auf sehr niedrige Temperaturen nahe dem absoluten Nullpunkt (0 K oder -273,15 °C) abgekühlt wird, verlieren die Wassermoleküle kinetische Energie und organisieren sich in einer hochgeordneten kristallinen Struktur, wodurch Eis entsteht. Unter diesen Bedingungen ist die thermische Energie so gering, dass die Moleküle kaum noch vibrieren und eine feste und regelmäßige Anordnung einnehmen.
Wenn sich die Temperatur dem absoluten Nullpunkt nähert, nimmt die verbleibende thermische Störung ab und die Eiskristalle erreichen einen Zustand maximaler Ordnung, in dem die Entropie minimal ist. Theoretisch würde es beim absoluten Nullpunkt keine molekulare Bewegung geben und das System wäre in seinem niedrigstmöglichen Entropiezustand.
Beispiel 2: Supraleitung
Supraleitung ist ein physikalisches Phänomen, das in bestimmten Materialien auftritt, wenn sie unter eine bestimmte kritische Temperatur abgekühlt werden. Bei dieser kritischen Temperatur weisen supraleitende Materialien eine einzigartige Eigenschaft auf: Der elektrische Widerstand verschwindet vollständig, sodass Strom ohne Energieverlust fließen kann.
Der Dritte Hauptsatz der Thermodynamik erklärt den Zusammenhang zwischen Supraleitung und der Verringerung der Entropie bei extrem niedrigen Temperaturen.
Wenn wir unter normalen Bedingungen einen elektrischen Strom durch einen Leiter, beispielsweise einen Kupferdraht, leiten, stoßen die Elektronen, die den Strom transportieren, auf Hindernisse und Kollisionen mit den Ionen des Materials, wodurch ein Widerstand gegen den Elektronenfluss entsteht. Dieser Widerstand ist für den Verlust von Energie in Form von Wärme verantwortlich und begrenzt die Effizienz elektrischer Geräte.
Doch in einem supraleitenden Material passiert bei sehr niedrigen Temperaturen nahe dem absoluten Nullpunkt etwas Erstaunliches: Elektronen bilden „Cooper-Paare“. Diese Paare bestehen aus zwei Elektronen, die sich verbinden und sich ohne Widerstand durch den Kristall bewegen.
Beispiel 3: Flüssiges Helium
 Helium ist bei Raumtemperatur ein inertes Gas, aber bei extrem niedrigen Temperaturen, nahe dem absoluten Nullpunkt, zeigt es ein faszinierendes und einzigartiges Verhalten. Bei ausreichender Abkühlung auf etwa unter 4,2 K verfestigt sich Helium nicht wie andere Gase, sondern wird flüssig.
Helium ist bei Raumtemperatur ein inertes Gas, aber bei extrem niedrigen Temperaturen, nahe dem absoluten Nullpunkt, zeigt es ein faszinierendes und einzigartiges Verhalten. Bei ausreichender Abkühlung auf etwa unter 4,2 K verfestigt sich Helium nicht wie andere Gase, sondern wird flüssig.
Wenn Helium abkühlt und flüssig wird, verlieren die Heliumatome Wärmeenergie, wodurch ihre Bewegung und Beweglichkeit verringert wird. Diese Abnahme der kinetischen Energie der Atome führt zu einer deutlichen Verringerung der Entropie. Bei noch niedrigeren Temperaturen weist Helium Quanteneigenschaften wie Suprafluidität auf, bei der es ohne Reibung fließt.
Wenn sich das System dem absoluten Nullpunkt nähert, nähert es sich einem Zustand nahezu perfekter Ordnung, in dem die Entropie auf ihr Minimum tendiert.
Beispiel 4: Bose-Einstein-Kondensate
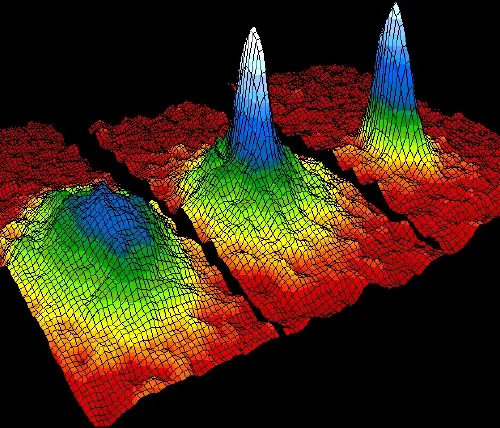 Bei Temperaturen nahe dem absoluten Nullpunkt verbinden sich einige Atome in einem besonderen Aggregatzustand, dem sogenannten Bose-Einstein-Kondensat.
Bei Temperaturen nahe dem absoluten Nullpunkt verbinden sich einige Atome in einem besonderen Aggregatzustand, dem sogenannten Bose-Einstein-Kondensat.
In diesem Quantenzustand verlieren Atome ihre Individualität und verhalten sich wie ein einziges Quantengebilde. Dieses Phänomen ist dank des dritten Hauptsatzes der Thermodynamik möglich, der besagt, dass die Entropie abnimmt, wenn extrem niedrige Temperaturen erreicht werden.
Dieses Phänomen wurde in den 1920er Jahren von Albert Einstein und dem indischen Physiker Satyendra Nath Bose vorhergesagt. Die Idee basiert auf der Bose-Einstein-Quantenstatistik, die das Verhalten identischer, nicht unterscheidbarer Teilchen wie Lichtphotonen oder der Atome beschreibt, aus denen bestimmte bestehen Elemente.
Unter normalen Bedingungen, bei höheren Temperaturen, folgen Teilchen einer statistischen Fermi-Dirac- (für Fermionen) oder Maxwell-Boltzmann-Verteilung (für Bosonen).
Wenn Teilchen jedoch auf extrem niedrige Temperaturen abgekühlt werden, beginnt ihr kollektives Quantenverhalten zu dominieren und sie neigen dazu, in den niedrigstmöglichen Energiezustand zu „kollabieren“. Zu diesem Zeitpunkt besetzen viele Teilchen einen einzigen Quantenzustand und bilden das sogenannte Bose-Einstein-Kondensat.
In diesem Quantenzustand verlieren die Teilchen ihre Individualität und verhalten sich wie ein kollektives „Superteilchen“ mit makroskopischen Quanteneigenschaften. Die gesamte Substanz wird zu einem einzigen Quantengebilde
Beispiel 5: Festes Helium
 Bei Temperaturen nahe dem absoluten Nullpunkt kann flüssiges Helium auch erstarren. Im festen Zustand zeigt Helium ein ungewöhnliches Verhalten, beispielsweise die Supraflüssigkeit, bei der es ohne Widerstand durch extrem enge Kapillaren fließen kann und damit den klassischen Gesetzen der Physik widerspricht.
Bei Temperaturen nahe dem absoluten Nullpunkt kann flüssiges Helium auch erstarren. Im festen Zustand zeigt Helium ein ungewöhnliches Verhalten, beispielsweise die Supraflüssigkeit, bei der es ohne Widerstand durch extrem enge Kapillaren fließen kann und damit den klassischen Gesetzen der Physik widerspricht.
Beispiel 6: Trockeneis
 Trockeneis ist Kohlendioxid (CO₂) in festem Zustand bei Temperaturen, die weit unter dem Gefrierpunkt von Wasser liegen. Im Gegensatz zu Wasser, das bei 0 °C gefriert, erstarrt CO₂ bei einer Temperatur von -78,5 °C (-109,3 °F) und normalem Atmosphärendruck direkt zu Trockeneis.
Trockeneis ist Kohlendioxid (CO₂) in festem Zustand bei Temperaturen, die weit unter dem Gefrierpunkt von Wasser liegen. Im Gegensatz zu Wasser, das bei 0 °C gefriert, erstarrt CO₂ bei einer Temperatur von -78,5 °C (-109,3 °F) und normalem Atmosphärendruck direkt zu Trockeneis.
Wenn Trockeneis Temperaturen nahe dem absoluten Nullpunkt hat, verhält es sich bei diesen extrem niedrigen Temperaturen ähnlich wie andere Feststoffe. Die CO₂-Moleküle, die Trockeneis bilden, reduzieren ihre kinetische Energie drastisch, was zu einer hochgeordneten Struktur und einem deutlichen Rückgang der Entropie führt. In diesem Zustand würde das Trockeneis bei Raumtemperatur seine maximal mögliche thermische Anordnung erreichen.
Trockeneis wird häufig als Kältemittel, in der Lebensmittelindustrie, beim Transport wärmeempfindlicher Materialien und als Spezialeffekt in der Theater- und Unterhaltungsindustrie eingesetzt.