
Die Gesetze der Thermodynamik sind eine Reihe von Prinzipien, die das Verhalten von Energie und Materie in Bezug auf Wärme und Arbeit regeln. Diese Gesetze bilden die Grundlage der Thermodynamik und gelten für eine Vielzahl physikalischer Systeme, von Wärmekraftmaschinen bis hin zu biologischen Prozessen und astrophysikalischen Phänomenen. Es gibt vier allgemein anerkannte Gesetze, die jeweils wesentliche Aspekte der Erhaltung, Übertragung und Abgabe von Energie in Systemen beschreiben.
Im Laufe der Zeit wurden diese Prinzipien aufgrund ihrer universellen Gültigkeit als „Gesetze“ akzeptiert. Obwohl in den letzten Jahrzehnten zusätzliche Formulierungen vorgeschlagen wurden, bilden die vier etablierten Gesetze weiterhin den grundlegenden Rahmen der Thermodynamik. Interessanterweise wurde das nullte Gesetz nach den anderen drei Hauptgesetzen formuliert, aufgrund seiner fundamentalen Natur erhielt es jedoch die „nullte“ Position.
Diese 4 Gesetze können je nach theoretischem und praktischem Kontext, in dem sie angewendet werden, auf unterschiedliche Weise ausgedrückt werden. Die gebräuchlichsten Formulierungen sind jedoch die folgenden:
Nullter Hauptsatz: Thermodynamisches Gleichgewicht
 Der nullte Hauptsatz besagt: „Wenn sich zwei thermodynamische Systeme im thermischen Gleichgewicht mit einem dritten System befinden, dann befinden sie sich auch untereinander im Gleichgewicht.“ Dieses Prinzip ist für die Definition der Temperatur von wesentlicher Bedeutung und ermöglicht die Existenz von Thermometern und den Temperaturvergleich zwischen verschiedenen Körpern. Die Formulierung dieses Gesetzes ermöglichte die strikte Festlegung des Konzepts des thermischen Gleichgewichts, also eines Zustands, in dem zwischen den sich berührenden Systemen kein Netto-Wärmetransfer stattfindet.
Der nullte Hauptsatz besagt: „Wenn sich zwei thermodynamische Systeme im thermischen Gleichgewicht mit einem dritten System befinden, dann befinden sie sich auch untereinander im Gleichgewicht.“ Dieses Prinzip ist für die Definition der Temperatur von wesentlicher Bedeutung und ermöglicht die Existenz von Thermometern und den Temperaturvergleich zwischen verschiedenen Körpern. Die Formulierung dieses Gesetzes ermöglichte die strikte Festlegung des Konzepts des thermischen Gleichgewichts, also eines Zustands, in dem zwischen den sich berührenden Systemen kein Netto-Wärmetransfer stattfindet.
In der Praxis bedeutet dieses Gesetz, dass, wenn ein Objekt A im thermischen Gleichgewicht mit einem Objekt B ist und B im thermischen Gleichgewicht mit einem Objekt C ist, dann sind A und C ebenfalls im thermischen Gleichgewicht. Dies ist von entscheidender Bedeutung für eine genaue Temperaturmessung und für die Definition von Temperaturskalen in Physik und Technik.
Erster Hauptsatz der Thermodynamik: Energieerhaltung
Der erste Hauptsatz der Thermodynamik, auch bekannt als Energieerhaltungssatz, besagt, dass „die gesamte Energie eines isolierten Systems weder erzeugt noch vernichtet, sondern nur von einer Form in eine andere umgewandelt werden kann.“ Dieses Gesetz hat weitreichende Auswirkungen auf zahlreiche Bereiche der Wissenschaft und Technologie, vom Ingenieurwesen bis zur Biologie.
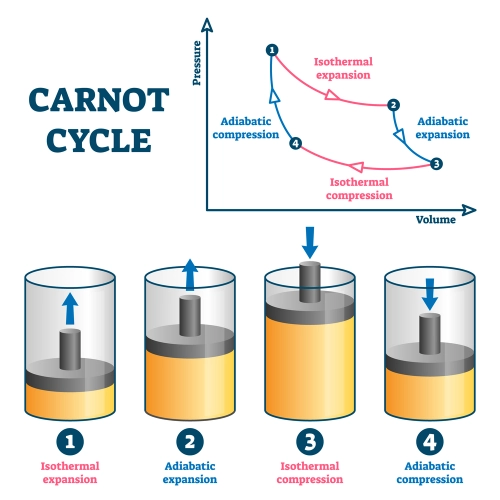
Ein alltägliches Beispiel für den ersten Hauptsatz ist eine Wärmekraftmaschine, bei der die chemische Energie des Brennstoffs in Wärmeenergie und anschließend in mechanische Arbeit umgewandelt wird. Mathematisch wird dieses Gesetz wie folgt ausgedrückt:
Wo:
- ΔU ist die Änderung der inneren Energie des Systems,
- Q ist die dem System zugeführte Wärme,
- W ist die vom System geleistete Arbeit.
Diese Gleichung spiegelt wider, dass jede Änderung der inneren Energie eines Systems auf Wärmeübertragung oder geleistete Arbeit zurückzuführen ist. Mit anderen Worten: Die Energie eines Systems kann nur durch Wechselwirkungen mit seiner Umgebung verändert werden.
Zweiter Hauptsatz der Thermodynamik: Entropie und Richtung von Prozessen
Der zweite Hauptsatz der Thermodynamik besagt, dass „die Entropie des Universums dazu neigt, zuzunehmen“. Die Entropie ist ein Maß für die Unordnung eines Systems und dieses Gesetz bestimmt die natürliche Richtung thermodynamischer Prozesse. Einfach ausgedrückt zerstreut sich die Energie und die Systeme geraten in einen Zustand größerer Unordnung, wenn kein äußerer Druck ausgeübt wird.
Dieses Gesetz hat mehrere wichtige Konsequenzen:
- Irreversibilität : Einige Prozesse, wie beispielsweise die Wärmeübertragung von einem heißen auf einen kalten Körper, sind unter natürlichen Bedingungen spontan und irreversibel.
- Wirkungsgrad von Wärmemaschinen : Keine Wärmemaschine kann einen Wirkungsgrad von 100 % aufweisen, da es immer zu Energieverlusten in Form von Wärme kommt.
- Evolution des Universums : Die fortschreitende Zunahme der Entropie lässt darauf schließen, dass sich das Universum in Richtung eines Zustands des endgültigen thermischen Gleichgewichts entwickelt, der als „Wärmetod“ bezeichnet wird.
Die mathematische Aussage des zweiten Gesetzes kann durch die Clausius-Ungleichung ausgedrückt werden:
Wobei die übertragene Wärmemenge und die absolute Temperatur ist. Bei irreversiblen Prozessen erhöht sich die Gesamtentropie des Systems und seiner Umgebung.
Dritter Hauptsatz der Thermodynamik: Absoluter Nullpunkt
 Der dritte Hauptsatz der Thermodynamik besagt, dass „ der absolute Nullpunkt durch eine endliche Anzahl physikalischer Prozesse nicht erreicht werden kann.“ Der absolute Nullpunkt liegt bei 0 Kelvin (-273,15 °C) und stellt die niedrigste mögliche Temperatur dar. Bei dieser Temperatur würden sich die Teilchen eines Systems theoretisch in ihrem Grundzustand minimaler Energie befinden und die Entropie würde einen konstanten Wert erreichen.
Der dritte Hauptsatz der Thermodynamik besagt, dass „ der absolute Nullpunkt durch eine endliche Anzahl physikalischer Prozesse nicht erreicht werden kann.“ Der absolute Nullpunkt liegt bei 0 Kelvin (-273,15 °C) und stellt die niedrigste mögliche Temperatur dar. Bei dieser Temperatur würden sich die Teilchen eines Systems theoretisch in ihrem Grundzustand minimaler Energie befinden und die Entropie würde einen konstanten Wert erreichen.
Mathematisch kann das dritte Gesetz wie folgt ausgedrückt werden:
Wo:
- S(T) ist die Entropie bei einer Temperatur T ,
- S 0 ist die Entropie beim absoluten Nullpunkt (T = 0) ,
- C p ist die spezifische Wärmekapazität bei konstantem Druck.
- T ist die Temperatur in Kelvin.
Dieses Gesetz hat wichtige Auswirkungen auf die Materialphysik und Kryotechnik. Wenn ein System bis zum absoluten Nullpunkt abkühlt:
- Die Entropie des Systems wird auf einen Minimalwert reduziert.
- Thermische Prozesse verlangsamen sich erheblich.
- Einige Substanzen unterliegen einem Phänomen, das als Bose-Einstein-Kondensation bekannt ist, bei dem eine große Anzahl Atome denselben Quantenzustand einnimmt.
Obwohl der absolute Nullpunkt in der Praxis unerreichbar ist, hat das Verständnis dieses Gesetzes Fortschritte in der Supraleitung und die Schaffung von Technologien ermöglicht, die bei extrem niedrigen Temperaturen arbeiten.