
Entropie ist in Physik und Chemie die Größe, die die Energie angibt, die in einem thermodynamischen Prozess keine praktische Arbeit leisten kann. Im Allgemeinen nimmt die Gesamtentropie des Universums tendenziell zu. Folglich zeigt die Entropie, also die Zunahme der Entropie, also die positive Änderung dieser Größe, den natürlichen Sinn an, in dem ein Ereignis in einem isolierten System auftritt.
Entropie (S) ist eine thermodynamische Größe, die ursprünglich als Kriterium zur Vorhersage der Entwicklung thermodynamischer Systeme definiert wurde. Bei jedem irreversiblen Prozess nimmt die Unordnung des Systems zu und damit die Entropie. Bei reversiblen Prozessen ist die Entropieänderung null.
Die Entropie eines Systems ist eine umfangreiche Zustandsfunktion. Der Wert dieser physikalischen Größe ist in einem geschlossenen System das Maß für die Unordnung, die ein Prozess auf natürliche Weise erzeugt. Der Begriff der Entropie beschreibt, wie irreversibel ein thermodynamisches System ist.
Beim nicht umkehrbaren Prozess wird aufgrund der Energieerhaltung ein Teil der Energie in Entropie umgewandelt.
Was ist die Einheit der Entropie?
Die Einheiten der Entropie im Internationalen System sind Joule/Kelvin (J/K) oder Clausius.
Wir definieren diese SI-Einheit als die Entropieänderung, die ein System erfährt, wenn es die thermische Energie von 1 Joule (Einheit) bei einer Temperatur von 1 Kelvin aufnimmt.
Was ist Standardentropie?
Die Standardentropie einer chemischen Verbindung ist ihre Entropie unter dem thermodynamischen Zustand von 1 atm Druck. Diese Werte werden in einer Entropietabelle ausgedrückt, die normalerweise bei einer Temperatur von 298 K angegeben wird.
Üblicherweise sind in diesen Tabellen auch die Bildungsenthalpien der chemischen Elemente in ihren auf Null gesetzten Normzuständen angegeben. Die Bildungsenthalpie ist die Energiemenge, die erforderlich ist, um diese Zusammensetzungen zu bilden.
Entropieformel in der Physik
In der Physik ist Entropie die thermodynamische Größe, die es ermöglicht, den Teil der Wärmeenergie zu berechnen, der nicht zur Erbringung von Arbeit verwendet werden kann, wenn der Prozess reversibel ist. Die physikalische Entropie in ihrer klassischen Form wird durch die von Rudolf Clausius vorgeschlagene Gleichung definiert:
dS=dQ / T
Woher:
-
dS ist die Variation der Entropie.
-
dQ ist die Änderung der Energie.
-
T ist die Temperatur.
oder einfacher, wenn die Temperatur im Prozess 1 → 2 konstant gehalten wird (isothermer Prozess):
Wenn also ein heißer Körper bei der Temperatur T1 eine Wärmemenge Q1 verliert, nimmt seine Entropie in Q1 / T1 ab. Überträgt er diese Wärme auf einen kalten Körper mit der Temperatur T2 (kleiner als T1), nimmt die Entropie des kalten Körpers stärker zu, als die Entropie des heißen Körpers abgenommen hat
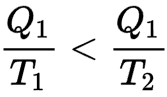
Ein reversierbarer Motor kann also einen Teil dieser Wärmeenergie in Arbeit umwandeln.
In der statistischen Mechanik ist die Boltzmann-Gleichung eine Wahrscheinlichkeitsgleichung, die die Entropie S eines idealen Gases mit der Größe W in Beziehung setzt, wobei die Anzahl der realen Mikrozustände dem Gas-Makrozustand entspricht:
S = kB lnW
wobei kB die Boltzmann-Konstante (auch einfach k geschrieben) und gleich 1,38065 × 10 –23 J/K ist.
Leistung einer reversiblen Wärmekraftmaschine
Die Leistung der reversiblen Maschine gibt das maximale Verhältnis von Energie an, das in Arbeit umgewandelt werden kann. Die folgende Formel kann diesen Zusammenhang ausdrücken:
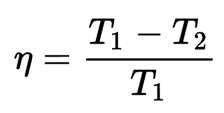
Damit die gesamte Wärmeenergie in Arbeit umgewandelt werden kann, müsste entweder die heiße Stelle eine unendliche Temperatur oder die kalte Stelle null Kelvin haben; Andernfalls ist der thermodynamische Wirkungsgrad des reversiblen Motors kleiner als 1.
Warum kann man die absolute Entropie nicht kennen?
Es ist unmöglich, die absolute Entropie in der realen Welt zu bestimmen, da dazu das Erreichen der Temperatur von null Kelvin erforderlich wäre.
In der Physik arbeiten wir immer mit Entropievariationen, denn um den absoluten Wert zu kennen, müsste man erst den absoluten Wert 0 erreichen. Um den absoluten Wert 0 zu erreichen, müsste das System auf null Kelvin abkühlen, damit sich die Moleküle nicht mehr bewegen. Von hier aus würde eine Erhöhung der Temperatur die Entropie erhöhen.
Aus physikalischer Sicht ist es jedoch nach dem Satz von Walther Nernst im dritten Hauptsatz der Thermodynamik unmöglich, die Temperatur von null Kelvin zu erreichen.