In der Thermodynamik ist ein isobarer Prozess eine Zustandsänderung einer bestimmten Materiemenge, bei der der Druck konstant bleibt . Was sich ändert, sind eine oder mehrere seiner Zustandsvariablen, wie zum Beispiel Volumen und Temperatur. Wird dem System Wärme zugeführt, wird Arbeit verrichtet und auch die innere Energie des Systems verändert sich.
Der isobare Prozess für ideale Gase folgt dem Gesetz von Charles. Nach diesem Gesetz ist bei einer festen Masse idealen Gases bei konstantem Druck das Volumen direkt proportional zur Temperatur in Kelvin.
Isobare Prozesse unterliegen dem ersten Hauptsatz der Thermodynamik. Bei diesen Prozessen ist der Anstieg der Enthalpie (ΔH) gleich der an das System übertragenen Wärme und die geleistete Arbeit ist P·ΔV. Die Beziehung zwischen innerer Energie, Arbeit und Wärme wird ausgedrückt als ΔU=Q−PΔV, mit Q=ΔH.
Definition eines isobaren Prozesses
Ein isobarer Prozess ist ein Prozess, bei dem der Druck konstant bleibt, während das System anderen Änderungen unterliegt. Technischer ausgedrückt sagt man, dass die Ableitung des Drucks nach der Zeit gleich Null ist, das heißt:
dP/dt=0
Diese Art von Prozess unterscheidet sich von anderen thermodynamischen Prozessen, wie z. B. isochoren Prozessen (bei denen das Volumen konstant ist), isothermen Prozessen (bei denen die Temperatur konstant ist) und adiabatischen Prozessen (bei denen keine Wärmeübertragung stattfindet).
Obwohl der Druck konstant bleibt, können sich andere Eigenschaften des Systems wie Volumen und Temperatur ändern. Wenn sich das Volumen des Systems ändert, wird Arbeit verrichtet, und diese Arbeit hängt mit der Volumenänderung unter konstantem Druck zusammen.
Beispiele für isobare Prozesse
Um diesen thermodynamischen Prozess besser zu verstehen, werden wir uns einige Beispiele ansehen.
-
Expansionsphase eines Motorzylinders.
-
Kochendes Wasser in einem offenen Behälter.
-
Erwärmung eines Globus durch die Einwirkung von Sonnenstrahlung.
Erhitzen der Luft in einem Ballon
Die Volumenänderung, die ein Ballon erfährt, wenn die Sonnenstrahlen auf ihn treffen, ist ein Beispiel für einen isobaren Prozess.
Zu Beginn des Morgens weist es einen bestimmten Druck, ein bestimmtes Volumen und eine bestimmte Temperatur auf. Wenn sich die Luft in seinem Inneren erwärmt, erhöht sich der Druck, der sich jedoch aufgrund der Volumenzunahme nicht ändert.
Expansionsphase des Zylinders einer Wärmekraftmaschine
Die Expansion von Luft in einem Zylinder mit beweglichem Kolben, dem Wärme zugeführt wird, erfolgt durch einen isobaren Prozess.
Das Volumen vergrößert sich proportional zur Temperatur und der Druck bleibt konstant. Dies steht im Einklang mit dem Gesetz von Charles.
Kochendes Wasser in einem offenen Behälter
Ein alltägliches Beispiel für einen isobaren Prozess ist das Kochen von Wasser in einem offenen Behälter. Indem dem Wasser Wärmeenergie zugeführt wird, erhöht sich die Temperatur und es entsteht Dampf.
Der gewonnene Dampf hat eine höhere Temperatur und nimmt ein größeres Volumen ein, der Druck bleibt jedoch konstant. Der Druck entspricht von Anfang an dem Atmosphärendruck.
Ideales Gasgesetz und isobare Prozesse
Um isobare Prozesse vollständig zu verstehen, ist es sinnvoll, die ideale Gaszustandsgleichung zu betrachten , die eine Beziehung zwischen Druck (P), Volumen (V), Temperatur (T) und der Gasmenge (n) in Mol herstellt zur Gleichung:
P·V=n·R·T
Wobei R die ideale Gaskonstante ist. Bei einem isobaren Prozess ist der Druck P konstant; Dies bedeutet, dass unter Bedingungen konstanten Drucks das Volumen eines idealen Gases direkt proportional zu seiner Temperatur ist.
Steigt bei einem isobaren Prozess die Temperatur eines Gases, nimmt auch dessen Volumen proportional zu, sinkt die Temperatur, nimmt das Volumen ab.
Diese Beziehung ist eine Form des Charles-Gesetzes, das einen Sonderfall des idealen Gasgesetzes für einen isobaren Prozess darstellt.
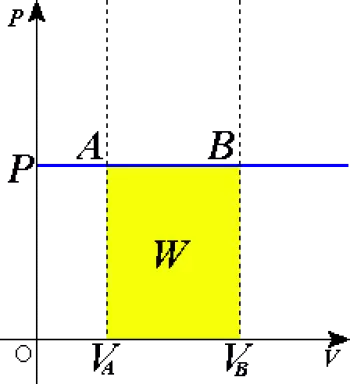
In einem isobaren Prozess geleistete Arbeit
 Einer der wichtigsten Aspekte isobarer Prozesse ist die Arbeit , die während des Prozesses vom oder am System geleistet wird.
Einer der wichtigsten Aspekte isobarer Prozesse ist die Arbeit , die während des Prozesses vom oder am System geleistet wird.
In einem thermodynamischen Prozess ist die vom System geleistete Arbeit wie folgt definiert:
W=∫P·dV
In einem isobaren Prozess, bei dem der Druck konstant ist, vereinfacht sich diese Gleichung zu:
W=P·ΔV
Dabei ist ΔV die Volumenänderung des Systems. Wenn das Volumen zunimmt, wirkt das System auf seine Umgebung ein, was bedeutet, dass sich das Gas ausdehnt. Wenn das Volumen abnimmt, verrichtet die Umgebung Arbeit am System und komprimiert das Gas.
Diese geleistete Arbeit ist gemäß dem zweiten Hauptsatz der Thermodynamik eng mit der Änderung der inneren Energie und der dem System zugeführten oder entzogenen Wärme verknüpft. Dieser besagt:
ΔU=Q−W
Wo:
- ΔU ist die Änderung der inneren Energie des Systems.
- Q ist die dem System zugeführte Wärme.
- W ist die vom System geleistete Arbeit.
Bei einem isobaren Prozess verändert die dem System zugeführte Wärme nicht nur die innere Energie des Systems, sondern wird aufgrund der Volumenänderung auch in Arbeit umgewandelt. Diese Eigenschaft unterscheidet sich von einem isochoren Prozess, bei dem die gesamte zugeführte Wärme in innere Energie umgewandelt wird, da in einem System mit konstantem Volumen keine Arbeit verrichtet wird.