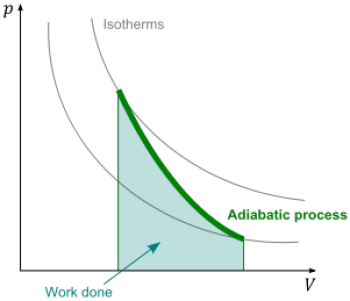
Ein adiabatischer Prozess ist ein thermodynamischer Prozess, bei dem ein System keine Wärme mit seiner Umgebung austauscht. Dies bedeutet, dass die Wärme, die in das System eintritt oder es verlässt, Null ist, d. h., die Veränderung der inneren Energie des Systems ist nur auf die an ihm oder von ihm verrichtete Arbeit zurückzuführen.
Der Begriff „adiabatisch“ bezieht sich auf jene Elemente oder Bedingungen, die einen Wärmeaustausch mit der Umgebung verhindern, wie beispielsweise eine adiabatische Wand, die keine Wärmeübertragung zulässt.
Die Annahme, dass ein Prozess adiabatisch ist, wird in vielen thermodynamischen Analysen häufig als vereinfachende Näherung verwendet, da sie die Berechnungen erleichtert. In der Praxis gibt es jedoch keine perfekt adiabatischen Systeme, obwohl sie in vielen Fällen angenähert werden können.
Das Konzept eines adiabatischen Prozesses ist grundlegend für das Verständnis und die Anwendung des ersten Hauptsatzes der Thermodynamik, da es die Beziehung zwischen Wärme, Arbeit und der inneren Energie eines Systems ohne Wärmeübertragung herstellt.
Beispiele für adiabatische Prozesse
Nachfolgend finden Sie einige Beispiele für adiabatische Prozesse in verschiedenen thermodynamischen Systemen:
Expansion und Kompression in einem Zylinder mit Gas
 In einem Verbrennungsmotor wird das Luft-Kraftstoff-Gemisch adiabatisch komprimiert, während sich der Kolben im Zylinder nach oben bewegt.
In einem Verbrennungsmotor wird das Luft-Kraftstoff-Gemisch adiabatisch komprimiert, während sich der Kolben im Zylinder nach oben bewegt.
Bei diesem Kompressionsprozess erhöht sich die Temperatur des Gases durch die schnelle Kompression und ohne Wärmeverlust an die Umgebung. Am Ende des Zyklus, wenn sich der Kolben nach unten bewegt, dehnt sich das Gas adiabatisch aus und verrichtet Arbeit am Kolben, ohne dass es zu einem Wärmeaustausch mit der Umgebung kommt.
Gasstrom durch eine Düse (Lavaldüse)
In einem Strahltriebwerk werden die Abgase beim Durchströmen einer Düse beschleunigt, was zu einer adiabatischen Expansion führt.
Bei diesem Vorgang dehnt sich das Gas schnell aus, vergrößert sein Volumen und verringert seinen Druck, ohne dass es zu einem Wärmeaustausch mit der Umgebung kommt. Die innere Energie des Gases wird in kinetische Energie umgewandelt, wodurch das Gas auf hohe Geschwindigkeiten beschleunigt werden kann und der zum Antrieb des Flugzeugs erforderliche Schub erzeugt wird.
Absenkung der Luft in der Atmosphäre (adiabatische Erwärmung)
Wenn eine Luftmasse in die Atmosphäre absinkt, wie es bei meteorologischen Phänomenen wie Föhn oder Chinook der Fall ist, wird die Luft adiabatisch komprimiert.
Dieser Vorgang führt zu einem Anstieg der Lufttemperatur, ohne dass eine Wärmeübertragung aus der Umgebung stattfindet.
Diese Art der Erwärmung trägt zur Bildung warmer Winde bei, die Bergregionen beeinflussen, und zur Vorhersage klimatischer Phänomene.
Kühlschränke und Klimaanlagen
In einem Kühlsystem, beispielsweise einer Klimaanlage, erfährt das Kältemittelgas eine adiabatische Expansion, wenn es durch das Expansionsventil strömt.
Bei diesem Vorgang sinken Druck und Temperatur des Gases schnell, ohne dass ein Wärmeaustausch mit der Umgebung stattfindet.
Schallerzeugung in Gasen
Schallwellen breiten sich durch adiabatische Prozesse in der Luft aus. Während sich die Schallwelle ausbreitet, werden die Luftpartikel schnell komprimiert und ausgedehnt, ohne dass Zeit für einen nennenswerten Wärmeaustausch bleibt.
Ausdehnung eines Heliumballons
Wenn Heliumgas in einen Ballon freigesetzt wird, dehnt sich das Gas adiabatisch aus. Steigt der Ballon in die Atmosphäre auf, dehnt sich das Helium aus, ohne dass es zu einem Wärmeaustausch mit der Umgebung kommt, da der Vorgang sehr schnell abläuft.
Durch die adiabatische Ausdehnung des Heliums im Ballon verringern sich dessen Druck und Temperatur, wodurch der Ballon aufsteigen kann.
Luftkompression in einem Luftkompressor
In einem Luftkompressor wird Luft adiabatisch komprimiert, wenn sie in ein kleineres Volumen eingeführt wird. Durch diesen Vorgang steigt die Lufttemperatur an, ohne dass die Wärme an die Umgebung abgegeben wird, wodurch sich die Luft erheblich erwärmt.
Die zum Komprimieren von Luft verwendete Energie erhöht deren innere Energie, die später beispielsweise für die Stromversorgung von Druckluftwerkzeugen oder in Kühlsystemen genutzt werden kann.
Kolben in einem Stirlingmotor
 Bei einem Stirlingmotor dehnt sich das Gas in den Zylindern während der Arbeitsphase adiabatisch aus. Bei der Ausdehnung des Gases wird am Kolben Arbeit verrichtet, es findet jedoch kein Wärmeaustausch mit der Umgebung statt.
Bei einem Stirlingmotor dehnt sich das Gas in den Zylindern während der Arbeitsphase adiabatisch aus. Bei der Ausdehnung des Gases wird am Kolben Arbeit verrichtet, es findet jedoch kein Wärmeaustausch mit der Umgebung statt.
Dieser Motortyp nutzt Temperaturschwankungen in einem adiabatischen Zyklus, um effizient Energie zu erzeugen, obwohl zusätzliche Mechanismen für den Wärmeaustausch in anderen Phasen des Zyklus erforderlich sind.
Zugehörige Konzepte
-
Ein isentropischer Prozess ist ein adiabatischer Prozess, der zudem reversibel ist. In diesem Fall behält das System auch eine konstante Entropie bei, was es zu einem idealen Prozess für verschiedene technische Anwendungen macht.
-
Eine adiabatische Wand ist eine Wand, die keinen Wärmeaustausch zwischen dem System und seiner Umgebung zulässt. In der Praxis kann eine isolierte Wand die Bedingungen einer adiabatischen Wand annähern, wenn auch nicht perfekt.
-
Ein adiabatisches System ist ein System, in dem kein Wärmeaustausch mit der Außenwelt zulässig ist. Dieses Konzept ist der Schlüssel zur Modellierung verschiedener thermodynamischer Prozesse und wird häufig in der Technik und Physik verwendet.
Adiabatische Heizung und Kühlung
Die adiabatische Kompression eines Gases führt zu einem Temperaturanstieg. Es erhöht auch die innere Energie des Gases. Durch die adiabatische Expansion kommt es zu einem Temperaturabfall.
Bei beiden Prozessen bleibt die Energie des Systems konstant. Es gibt keinen Wärmegewinn oder -verlust. Im Gegensatz dazu ist die freie Expansion bei einem idealen Gas ein isothermer Prozess.
Solche Temperaturänderungen können quantifiziert werden durch:
- Das ideale Gasgesetz.
- Die hydrostatische Gleichung für atmosphärische Prozesse.
Adiabatische Erwärmung tritt auf, wenn der Druck eines Gases aufgrund der Arbeit, die seine Umgebung an ihm verrichtet, zunimmt.
Adiabatische Kühlung tritt auf, wenn der Druck über einem adiabatisch isolierten System abnimmt. Diese Verringerung ermöglicht eine Ausdehnung. Mit zunehmendem Volumen nehmen Temperatur und innere Energie ab.