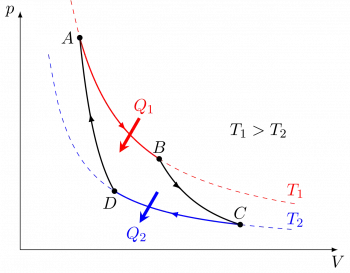
Der Carnot-Zyklus ist ein grundlegendes Konzept der Thermodynamik und stellt ein ideales Modell einer reversiblen Wärmekraftmaschine dar, die zwischen zwei Wärmequellen arbeitet, einer heißen und einer kalten.
Dieser Zyklus wurde 1824 vom französischen Physiker Sadi Carnot vorgeschlagen und ist wichtig, um die theoretischen Grenzen der Effizienz von Wärmekraftmaschinen zu verstehen.
Der Carnot-Zyklus ist ein ideales Modell und kann aufgrund der unvermeidlichen Verluste und Reibungen in realen Systemen in der Praxis nicht vollständig umgesetzt werden. Es dient jedoch als wichtige theoretische Referenz zum Verständnis der Grenzen der Effizienz von Wärmekraftmaschinen unter idealen Bedingungen.
Phasen des Carnot-Zyklus
Der Carnot-Zyklus besteht aus vier reversiblen Stufen, die in zwei isothermen Prozessen (bei konstanter Temperatur) und zwei adiabatischen Prozessen (ohne Wärmeübertragung) ablaufen:
-
Isothermer Prozess (isochorische Erwärmung): In dieser Phase wird das System (z. B. ein Gas) mit einer heißen Wärmequelle mit einer Temperatur Th in Kontakt gebracht und expandiert isotherm, wobei während des gesamten Prozesses eine konstante Temperatur aufrechterhalten wird. Während dieses Schritts nimmt das System Wärme von der heißen Quelle auf.
-
Adiabatischer Prozess (adiabatische Expansion): In diesem Stadium ist das System thermisch isoliert, sodass keine Wärmeübertragung mit der Umgebung stattfindet. Das Gas dehnt sich weiter aus und verrichtet dabei Arbeit an der Umgebung, wodurch seine Temperatur sinkt.
-
Isothermer Prozess (isochore Abkühlung): Das System kommt mit einer kalten Wärmequelle mit einer Temperatur Tc in Kontakt. In dieser Phase wird das Gas isotherm komprimiert, wodurch eine konstante Temperatur aufrechterhalten und Wärme an die Kältequelle abgegeben wird.
-
Adiabatischer Prozess (adiabatische Kompression): Das System wird wieder thermisch isoliert, sodass kein Wärmeübergang mit der Umgebung stattfindet. Das Gas wird adiabatisch komprimiert, verrichtet Arbeit am System und erhöht dessen Temperatur.
Nach Abschluss dieser vier Phasen kehrt das System in seinen Ausgangszustand zurück und der Zyklus kann wiederholt werden.
Effizienz
Der Wirkungsgrad des Carnot-Zyklus ist definiert als das Verhältnis zwischen der geleisteten Nettoarbeit und der von der heißen Quelle aufgenommenen Wärme:
Effizienz = 1 – (T c / T h )
Dabei ist T c die Temperatur der kalten Quelle und T h die Temperatur der heißen Quelle.
Der Wirkungsgrad des Carnot-Zyklus ist der maximal mögliche für jede Wärmekraftmaschine, die zwischen denselben beiden Temperaturen T c und T h arbeitet .
Carnot-Maschine
Ein Carnot-Motor ist eine reversible Wärmekraftmaschine, die zwischen zwei Wärmequellen arbeitet, einer heißen und einer kalten, und ihre Arbeit aus dem Wärmefluss zwischen diesen beiden Quellen bezieht.
Diese theoretische Maschine wird verwendet, um die Grundprinzipien der Thermodynamik zu veranschaulichen und die theoretischen Grenzen des Wirkungsgrades für jede Wärmekraftmaschine festzulegen.
Umgekehrter Carnot-Zyklus
Der inverse Carnot-Zyklus, auch Carnot-Kühlschrank oder Carnot-Kältemaschine genannt, ist das umgekehrte Konzept des klassischen Carnot-Zyklus.
Während der Carnot-Zyklus eine Wärmekraftmaschine beschreibt, die Wärme in Arbeit umwandelt, beschreibt der umgekehrte Carnot-Zyklus einen Kühlmotor, der Arbeit leistet, um Wärme von einer kalten Quelle auf eine heiße Quelle zu übertragen, und zwar entgegen dem natürlichen Wärmefluss.
Die Hauptaufgabe eines Kühlschranks oder einer Kältemaschine besteht darin, einen Bereich oder ein System auf einer niedrigeren Temperatur als die Umgebungstemperatur zu halten. Um dies zu erreichen, ist ein externer Energieeintrag (Arbeit) zur Durchführung des Kühlvorgangs erforderlich.
Der umgekehrte Carnot-Zyklus besteht wie der klassische Carnot-Zyklus aus vier reversiblen Phasen, die Richtungen der Prozesse sind jedoch entgegengesetzt:
-
Adiabatischer Prozess (Adiabatische Kompression): In dieser Phase wird das Kältemittel adiabatisch komprimiert, wodurch sich seine Temperatur und sein Druck erhöhen. Am Kältemittel wird gearbeitet, um es zu komprimieren.
-
Isothermer Prozess (isochore Erwärmung): Das Kältemittel kommt mit der heißen Quelle mit einer Temperatur T h in Kontakt . Während dieses Schritts nimmt das Kältemittel Wärme von der heißen Quelle auf, während seine Temperatur konstant bleibt.
-
Adiabatischer Prozess (adiabatische Expansion): In dieser Phase expandiert das Kältemittel adiabatisch, wodurch seine Temperatur und sein Druck sinken. Es werden Arbeiten am System durchgeführt, um eine adiabatische Expansion zu ermöglichen.
-
Isothermer Prozess (isochore Abkühlung): Das Kältemittel kommt mit der Kältequelle bei einer Temperatur T c in Kontakt . In dieser Phase gibt das Kältemittel Wärme an die Kältequelle ab und sorgt so für eine konstante Temperatur.
Nach Abschluss dieser vier Phasen kehrt das Kältemittel in seinen Ausgangszustand zurück und der Zyklus kann wiederholt werden, um den Kühlprozess aufrechtzuerhalten.
Bedeutung des Carnot-Zyklus
Der Carnot-Zyklus ist aus mehreren grundlegenden Gründen für die Thermodynamik und die Wissenschaft im Allgemeinen von großer Bedeutung:
Der Carnot-Zyklus ist aus mehreren grundlegenden Gründen für die Thermodynamik und die Wissenschaft im Allgemeinen von großer Bedeutung:
1. Legen Sie theoretische Effizienzgrenzen fest
Dieser Zyklus bietet den maximal möglichen theoretischen Wirkungsgrad für jede Wärmekraftmaschine, die zwischen zwei Wärmequellen mit unterschiedlichen Temperaturen betrieben wird.
Der maximale Wirkungsgrad wird nur dann erreicht, wenn der Kreislauf vollständig reversibel ist und dieser Maximalwert ausschließlich durch die Temperaturen der beteiligten Wärmequellen bestimmt wird.
2. Es ermöglicht uns, Reversibilität zu verstehen
Der Carnot-Zyklus ist vollständig reversibel, was bedeutet, dass er in beide Richtungen arbeiten kann, sowohl als Wärmekraftmaschine, die Wärme in Arbeit umwandelt, als auch als Kühlschrank, der Wärme von einer kalten zu einer heißen Quelle überträgt.
Diese theoretische Reversibilität ist wichtig, um die Konzepte der Irreversibilität und der Energieverluste in realen Systemen zu verstehen. In der Praxis sind reale Maschinen immer weniger effizient und daher teilweise irreversibel.
3. Hilfe bei der Gestaltung und Verbesserung thermischer Systeme
Obwohl der Carnot-Zyklus ein ideales Modell ist und aufgrund unvermeidlicher Verluste und Reibung nicht perfekt in reale Systeme implementiert werden kann, bietet er wertvolle Hinweise für den Entwurf und die Verbesserung thermischer Systeme.
Ingenieure und Wissenschaftler nutzen es als Referenz, um die Leistung von Wärmekraftmaschinen wie Motoren und Generatoren sowie Kühlsystemen zu bewerten und Bereiche für Effizienzverbesserungen zu identifizieren.
4. Trägt zum Verständnis der Thermodynamik bei
Der Carnot-Zyklus ist ein grundlegender Baustein der Thermodynamik und bietet eine solide Grundlage für die Untersuchung anderer thermodynamischer Kreisläufe, wie des Rankine-Zyklus in Kraftwerken und des Brayton-Zyklus in Gasturbinen.
Darüber hinaus hilft der Carnot-Zyklus, Schlüsselkonzepte der Thermodynamik wie Arbeit, Wärme, Entropie und Energieübertragung in thermischen Systemen zu verstehen.